核電荷(nuclear charge)
為什麼要討論「核電荷」?因為這會影響電子的「穩定程度」
簡單來說,核電荷是質子的總數,也就是原子核的正電荷總量總量
通常以 Z 來表示
Z:原子序(=質子數),原子序越大代表核電荷越強

眾所皆知
原子核(質子)帶正電、電子帶負電
由於正負相吸,當核電荷越大時,電子與核之間的吸引力越大
電子會被吸得更緊、更靠近原子核,自身能量更低、也就更「安定」
(這邊指的是在電子數量不變、只有質子數量增加的情況)
遮蔽效應(shielding effect)
眾所皆知
同性相斥、異性相吸
由於電子與電子之間有排斥力作用(同性相斥),削弱了該電子與原子核(異性相吸)之間的吸引。
就像兩個男生追一個女生,因為怕女性對象被追走
男生都會把另一個情敵推的遠遠的,不讓對方靠近女性對象
甚至干擾情敵的認知(講一些負面傳聞),讓情敵不那麼想追她
女生還是很有吸引力(Z 很高)
但是男生們推擠來去、被互相干擾,都沒辦法接近那位女生(原子核)
導致男生都變成光棍
這種現象就稱為「遮蔽效應」,或者屏蔽效應(shielding effect)

有效核電荷(effective nuclear charge)
為了理解「有效核電荷」,這裡引入「幼稚園」的概念來幫助我們理解和估算
在小幼稚園裡面,有這兩種角色:
質子(穩重盡責的老師)、電子(愛跑來跑去的小朋友)
老師們會照顧小朋友
然而,一間「標榜有11個老師」的學校,
把小孩送過去就真的能受到11個老師的照顧嗎?
不可能,實際上只有「有空的老師」,會來照顧外圍的小朋友
因為老師們會先被內層的小朋友纏住(抱大腿的、爬身上的、吵著要尿尿)
佔據了老師注意力

在微觀的世界也是如此
不是每顆跑來跑去的電子,都能感受到「核電荷的完整照顧」
「有效核電荷」是最外層電子「實際感受到」的原子核吸引力
公式為:![]() (有效核電荷 = 真實核電荷 – 被屏蔽的程度)
(有效核電荷 = 真實核電荷 – 被屏蔽的程度)
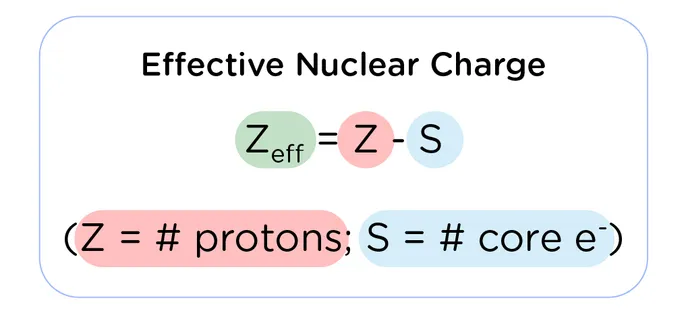
Z_eff:有效核電荷 (Effective Nuclear Charge)
S:遮蔽常數 (Shielding Constant),被前排電子遮蔽的核吸引力
ex:
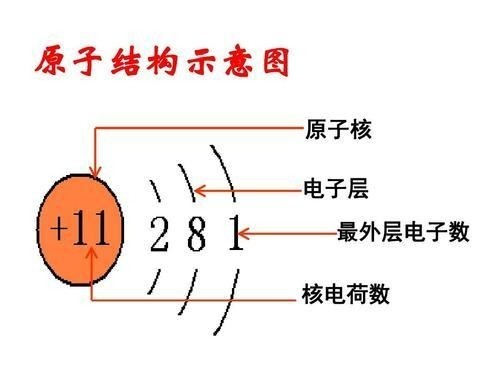
🧪 Na(鈉)
電子排布:![]() → 電子殼層:2 8 1
→ 電子殼層:2 8 1
Z = 11,內層電子 = 2 + 8 → Z_eff = 11 – 10 = 1
班級有11位老師,前面有10個小朋友吵著要尿尿(遮蔽效應強)
只有一個老師有辦法看著最外層電子
所以最外圍的這顆電子,很容易游離、被拔走(被外面大叔叔大嬸嬸拐走),形成Na⁺
🧪 Ar(氬)
電子排布:![]() → 電子殼層:2 8 8
→ 電子殼層:2 8 8
Z = 18,內層電子 = 2 + 8 → Z_eff = 18 – 10 = 8
班級有18位老師,內層一樣是10個小朋友要尿尿,但老師數量多了很多
最外層電子被8個老師共同照顧、緊緊看著(感覺小朋友壓力很大- -“),不會被拐走
所以很穩定,是惰性氣體
以上這些,也可以都用「在電影院內觀看電影」來想
我實際的視野(Z_eff) = 螢幕的大小(Z) - 前排觀眾頭擋住我的視線(S)
ex:
🧪 Li(鋰)
電子排布:![]() → 電子殼層:2, 1
→ 電子殼層:2, 1
Z= 3,內層電子 = 2 → Z_eff = 3 – 2 = 1
這間電影院又小又擠,螢幕大小只有3格
我的視線被前面兩顆大頭擋住了,只剩下1格縫隙能看電影
讓我看得不是很爽,隨時想離開,所以不穩定

🧪 Ne(氖)
電子排布:![]() → 電子殼層:2, 8
→ 電子殼層:2, 8
Z = 10,內層電子 = 2 → Z_eff = 10 – 2 = 8
電影院大了點,螢幕有10格大
雖然前面又被那兩顆大頭擋著,但我能透過剩下的8格清楚地觀看整部電影
看著挺舒服的、完全沒想離開,所以很安定
畢竟只是一加一減的數學計算
所以上述計算的方法只是粗估、抓個大概的估計值
運用這套公式,套用在每個原子上整理成表:
| 元素 | H | He |
| 原子序 | 1 | 2 |
| 遮蔽數 | 0 | 0 |
| Z_eff | 1 | 2 |
| 元素 | Li | Be | B | C | N | O | F | Ne |
| 原子序 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 遮蔽數 | 2 | 2 | 2 | 2 | 2 | 2 | 2 | 2 |
| Z_eff | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 元素 | Na | Mg | Al | Si | P | S | Cl | Ar |
| 原子序 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 遮蔽數 | 10 | 10 | 10 | 10 | 10 | 10 | 10 | 10 |
| Z_eff | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
下圖是較貼近真實的 Z_eff 數值
並且有詳列出每一層電子感受到的「有效核電荷」
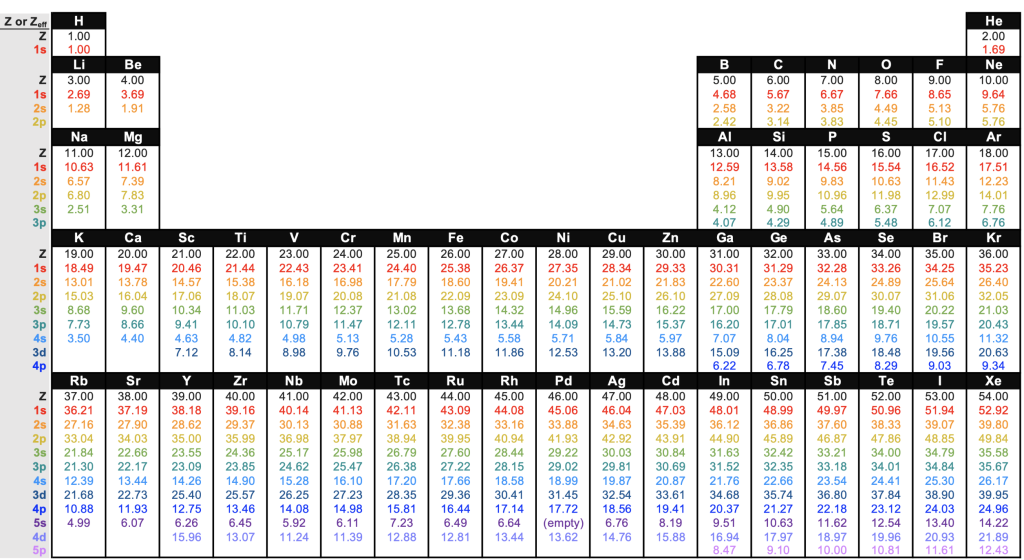
每一個班級的老師(保母)數量不一樣,
小朋友的座位安排(內外層電子)也錯綜複雜
加上2p會受到2s遮蔽、2s又會受到1s遮擋… 如此往復推算
導致每個小朋友受到照顧的程度有所不同
每一層的電子感受到的「有效核電荷」都不一樣
真實世界的情況就是如此複雜多元
BTW
這張圖的矛盾之處在於
Z_eff 明明在增加,為何外層電子卻越來越「鬆」?
K 最外層電子 享受到的有效核電荷比 Na 還要大,應該要更穩定才對
但事實上 K 卻比 Na 更不穩定、更容易游離
(在週期表中,同一族元素 往下排移動,活性增加、越不安定)
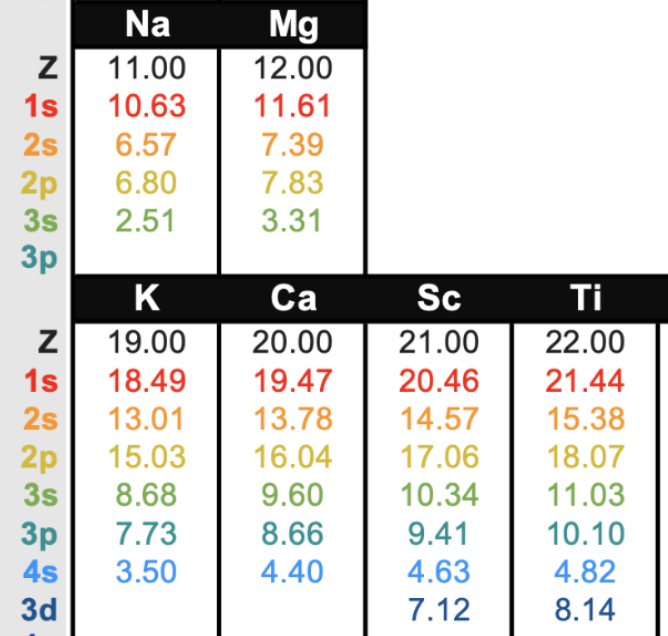
因為,Z_eff 只說明
電子感受到「核心正電」有多強,但沒有告訴我們電子「離核多遠」
就像,說明了小朋友「受到幾位老師照顧」,卻沒說小朋友「距離老師幾百公尺遠」
Z_eff 闡述了「往右遞增」趨勢,適合放在同一週期(同一橫排)比較
但是不適用於「跨週期」不同橫排之間的比較

發佈留言