【化學理解】
軌道半徑大小
電子的軌道半徑 n=1, 2, 3, 4… (分別對應k, l, m, n)
其中n是主量子數,代表軌域範圍
在波爾模型中,軌道半徑大小不是等距離增加,而是平方倍增加
n=1層 => r=1×1
n=2層 => r=2×2
n=3層 => r=3×3
n=4層 => r=4×4
其中的r為 氫原子在基態(n=1)下,平均軌道半徑為 0.529 Å (波爾半徑)
也就是說
n=2 -> 1 移動距離是3r
n=4 -> 1 移動距離是15r
(僅適用單電子系統,在多電子系統中距離會有誤差)
p.s. 教科書的等距軌道是示意圖,並沒有按照真實比例繪製
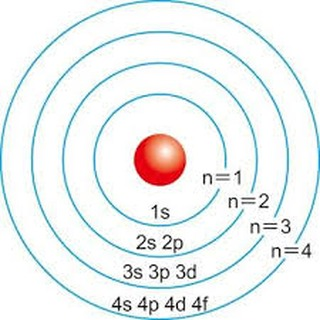
真實軌域的比例為紅框處
為何僅適用單電子系統?
在同樣的軌道上,當原子核越大(質子數𝑍↑)的時候,因為受到正負相吸的力更大,所以電子軌道半徑越小。
並且在多電子系統中,電子與電子會有排斥力,也會影響軌域。
公式為:![]()
其中 ![]() 為有效核電荷;
為有效核電荷;![]() 為原子序;
為原子序;![]() 為波爾半徑
為波爾半徑
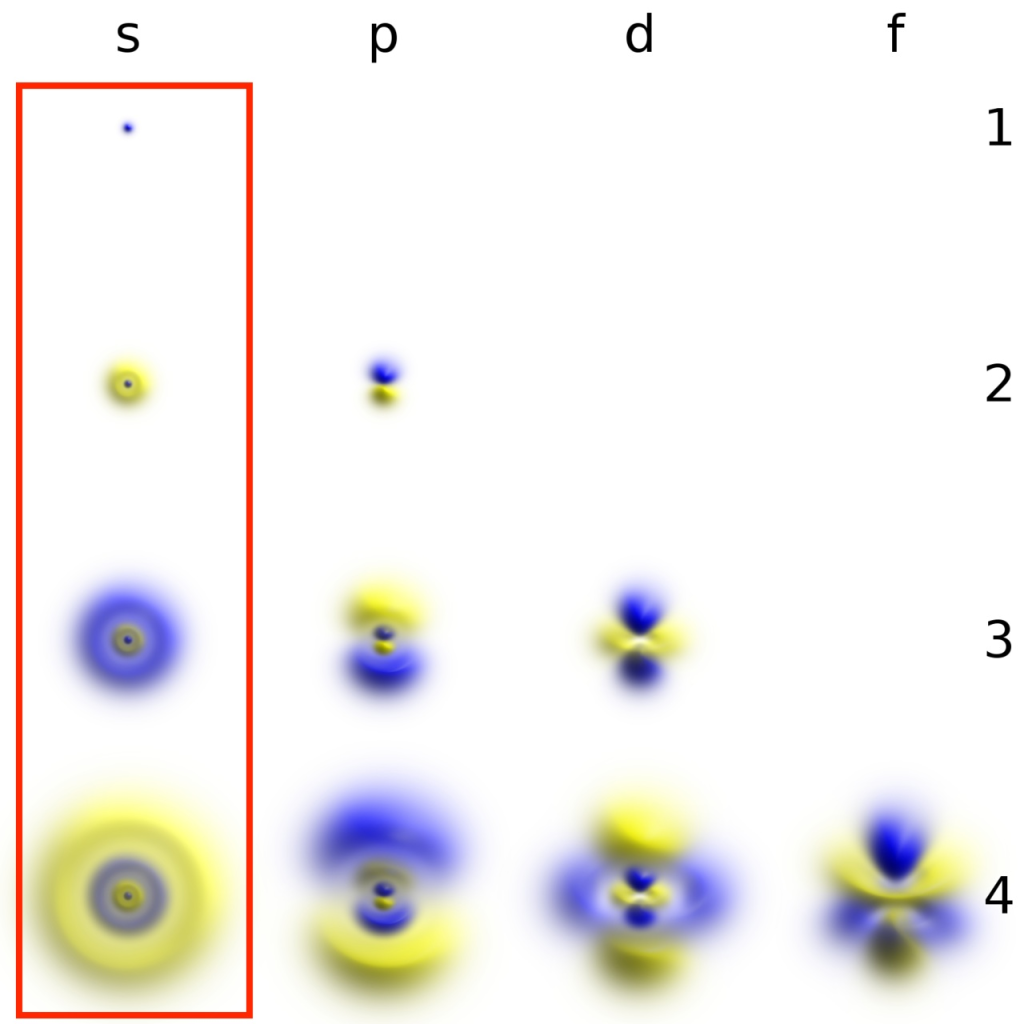
電子機率密度
上述是比較直觀的思路
真實情況是電子的位置為機率分佈,實際上都是透過波函數計算機率密度(電子在距離原子核多遠的位置出現的概率有多大)
我們僅能得知「電子最可能出現的位置」,並非具體的“距離”
實際上 n=1 -> 2 是狀態的切換,並非電子真正移動
因為n=1軌道的電子有低概率會比n=2軌道電子還要遠
最精確是看函數的圖形
繪製出的球狀圖形代表電子「最高機率出現」的位置,是簡化後的視覺化工具
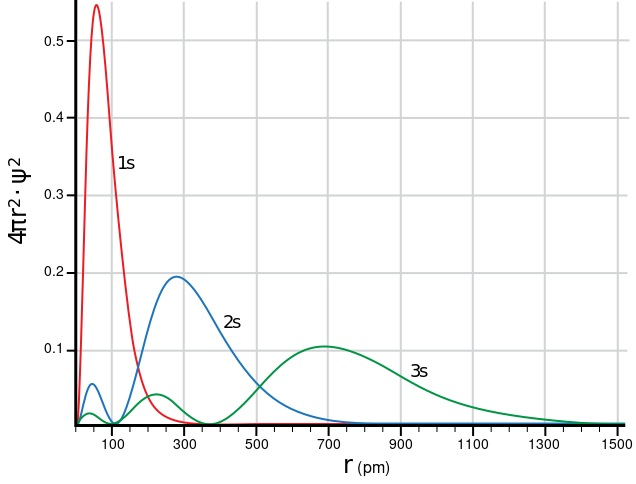
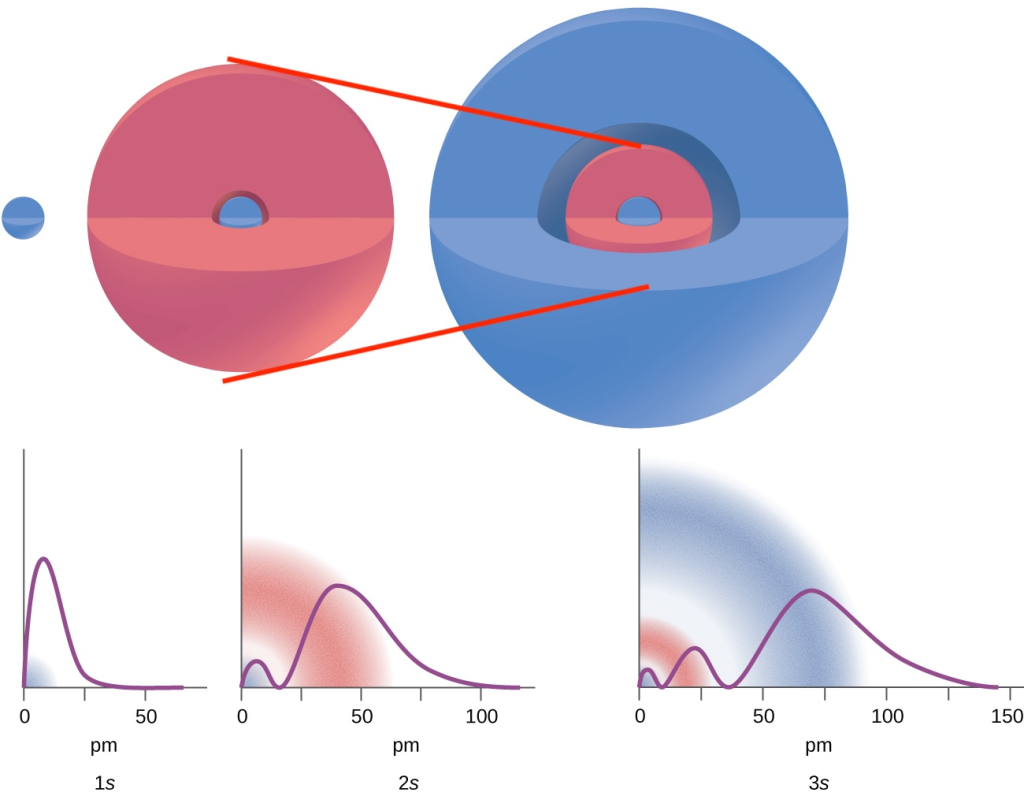
不過為了方便理解,暫時先用軌道來思考比較容易
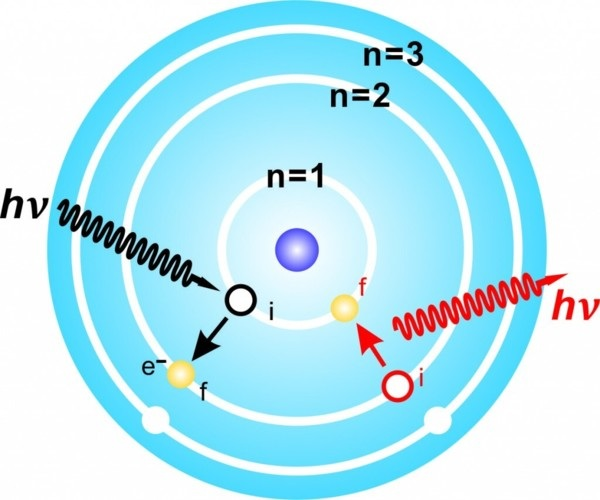
電子躍遷
電子在不同軌道間移動,這種狀態切換,就稱作“電子躍遷”
當n越大,電子的「位能」越高,代表在這個位置儲存越多能量
- 往內躍遷 (ex: n=2 -> 1),會釋放能量,因為到達相對穩定的狀態
- 往外躍遷(ex: n=2 -> 3),會吸收能量,因為這裡相對不穩定
躍遷能量會以光子形式(電磁波)表現
當n=1時,代表電子此時處在最靠近原子核的位置
當n=∞時,電子在最遠離原子核的位置,因距離太遠,所受原子核的影響可忽略不計
所以當
1. 電子從軌道n=∞ -> 1時,這過程會釋放最大的能量
在氫原子光譜中,即便是最高的能量也只能釋放UV紫外線(萊曼譜系Lyman Series)
那那那,能量比UV更強的光是怎麼來的?
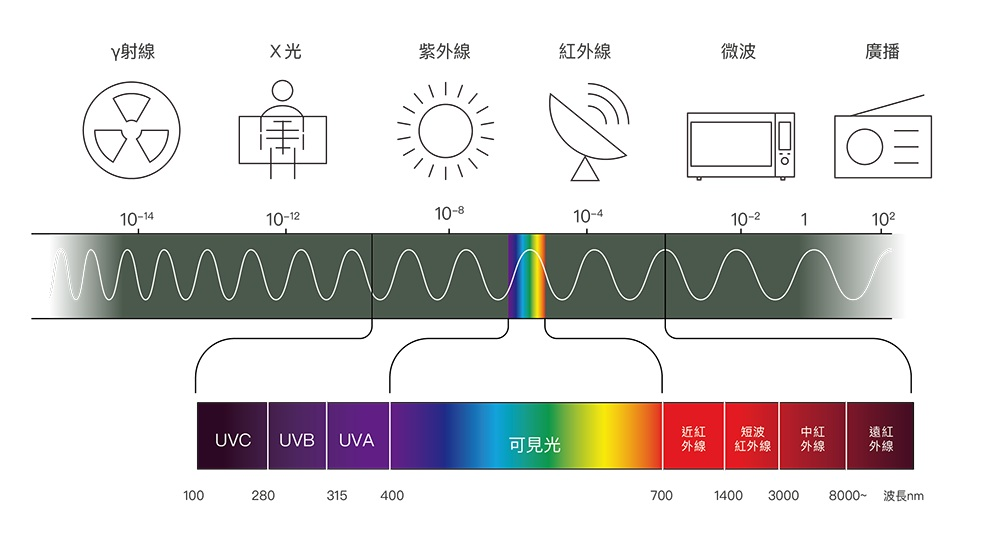
要釋放 X射線(X-ray),需要”更重元素(ex: 鉛、鎢)“的電子躍遷
原因是當”質子數“越多時,電子能感受更強的力道
然而
伽馬射線(γ-ray)並非電子躍遷造成的,而是“原子核不穩定”造成核衰變或核反應導致
因為電子躍遷能量遠遠小於此
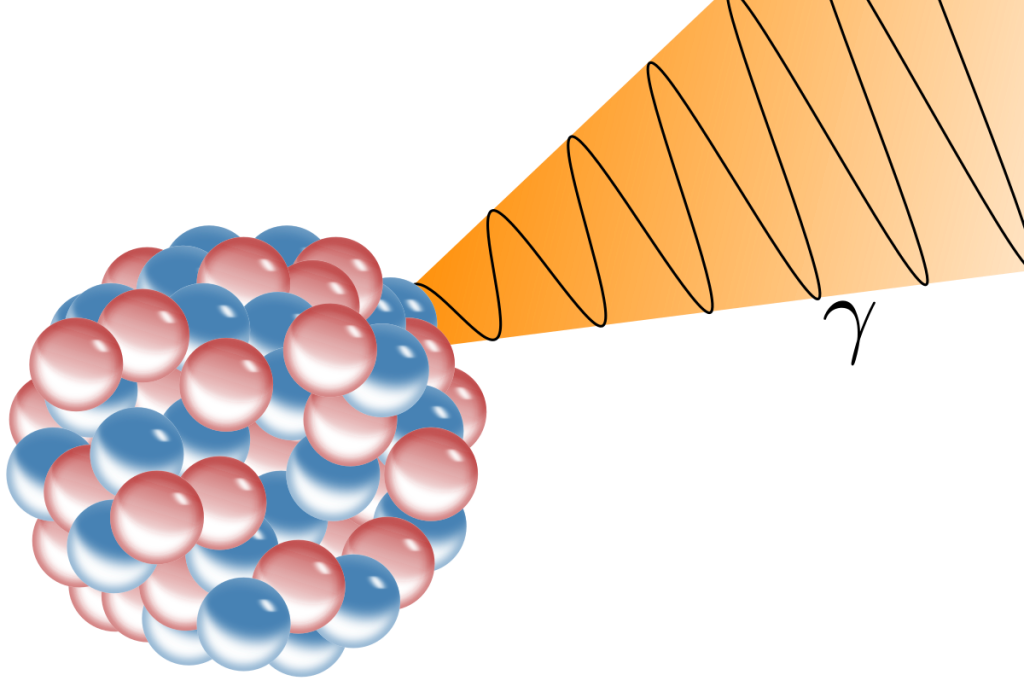
束縛原子核的能量,遠遠比束縛電子的能量還要大(核能是電子能量的數百萬倍大)
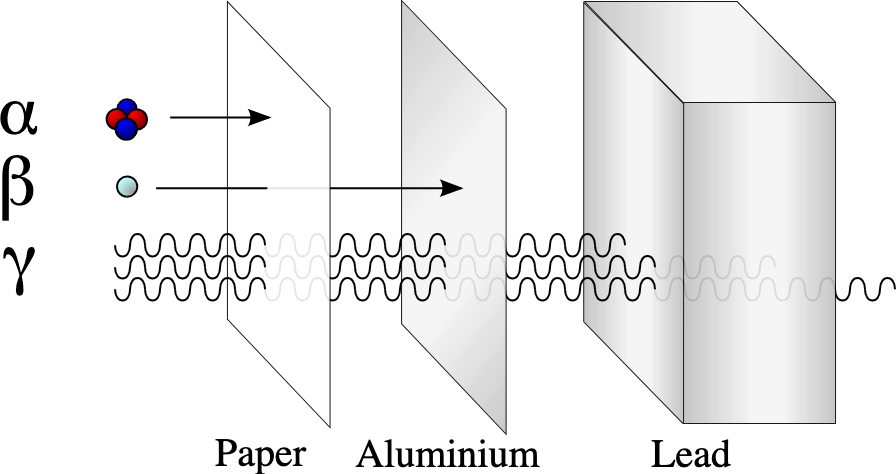
“放射性元素”例如: 鐳(Ra)、鈾(U)等,都是原子核內造成的衰變
ex: α衰變(釋放He核)、β衰變(釋放電子)、γ衰變(釋放伽馬射線)
2. 當電子移動到n=∞時,代表已經脫離原子核的束縛,電子變成自由電子,在這過程中所耗費能量就是游離能
然而我很好奇,n=∞是什麼概念
從理論上來說軌道數量沒有上限,但是實際上不可能無限大
地球上的原子,元素基態只能填到n=7層
如果想再往更上一層樓,需要靠額外能量“激發”
於是就有個 專指n很大的原子 — “里德伯原子(芮得柏原子 Rydberg atom)”
芮得柏原子
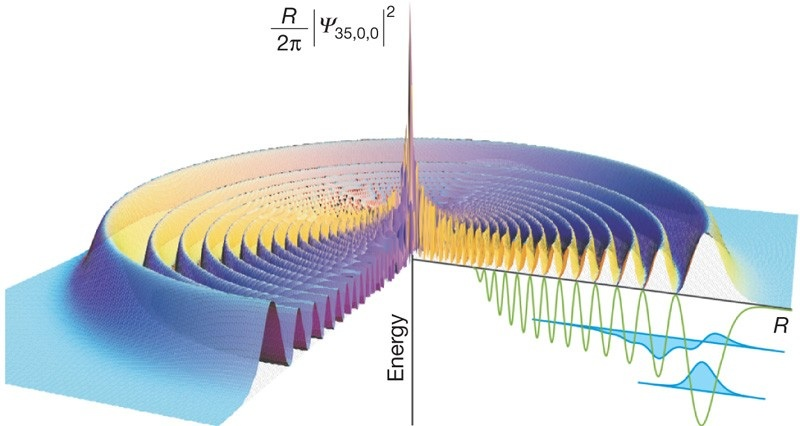
當n=100時,原子接近病毒的大小
當n=250時,原子像是細菌、細胞那麼大
當n=1000時,原子會接近頭髮直徑的大小
這根本就是超巨型原子!
非常好奇這看起來會是怎樣?
然而即便如此巨大,我們實際上仍“看不到”此原子
因為這個在這範圍中只有一個原子存在,原子體積大部分被單一個電子所佔據,絕大部分區域仍然是空的,物質密度極低
目前在實驗室中能做出來的大約是n=100左右
人類觀測到的最高紀錄(highest-𝑛 Rydberg state)是n=1200
這種特性(高度激發態、長距離相互作用能力)也與量子電腦的實作方式有關

發佈留言