蒸發與沸騰的微觀層面
不只有水,世上所有東西都會自然蒸發,這顛覆了我的想像…
我們先來看生活中最常見的「水」的蒸發速度
相對濕度(RH)決定蒸發速率,RH 越低蒸發越快,RH 越高蒸發越慢
相對濕度(RH, Relative Humidity):
![]()
![]() :目前水蒸氣分壓
:目前水蒸氣分壓![]() (或寫成
(或寫成 ![]() ):飽和水蒸氣壓力(Saturation Vapor Pressure)
):飽和水蒸氣壓力(Saturation Vapor Pressure)
當RH = 0% 時,水分完全沒有受到空氣中水氣的反壓,蒸發速度最快
當RH > 90% 時,空氣中水氣幾近飽和,水分蒸發速度變慢,汗液難以蒸發,人體感覺悶熱、黏膩
當RH = 100% 時,空氣到達飽和,蒸發趨近於0(蒸發速率 = 冷凝速率),易起霧、下雨、結露
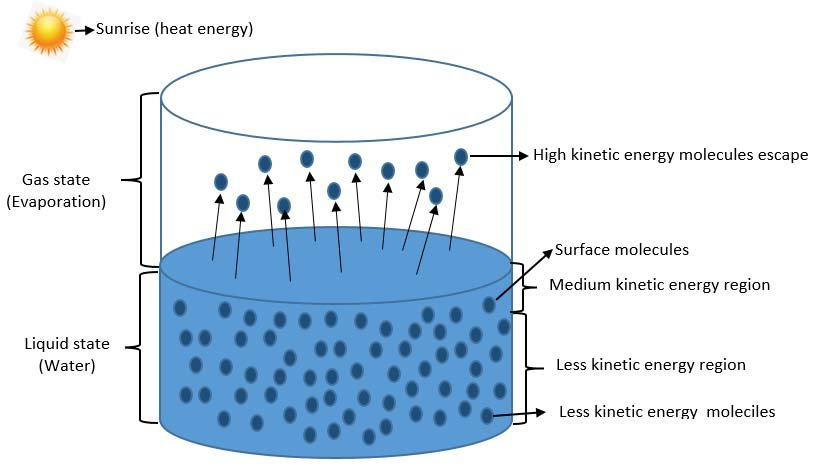
液體在任何溫度都會蒸發,僅僅發生在表面
但是達到飽和蒸氣壓,就會停止蒸發
(其實不是停止,而是達平衡 蒸發速度=凝結速度)
但,一旦溫度到達沸點時
水分子會集體暴動,由內而外自發、爭先恐後的變成氣體,不斷往外推擠
沸點的定義
(從最Low到高階精準的說法):
1 (國中程度)100℃2 (高中程度)發生沸騰時的溫度3 (大學程度)當飽和蒸汽壓 = 大氣壓(外部壓力) 的時候
也就是 ![]() (或寫成
(或寫成 ![]() )
)
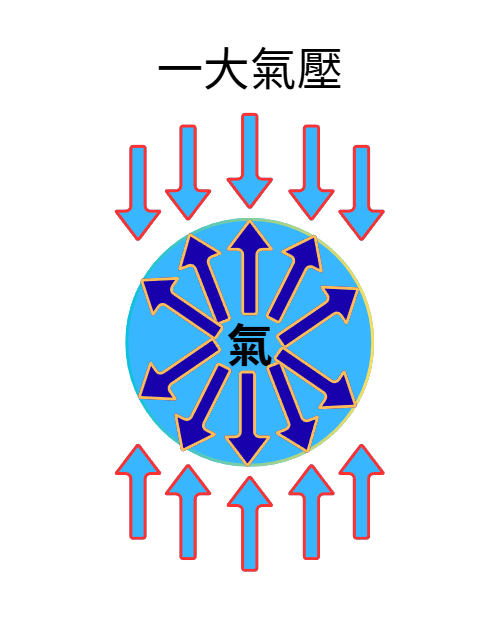
我們來看一個小氣泡、從微觀角度出發,聚焦在這個粒子身上
因為外界本身具有壓力(大氣壓)
而氣泡內本身有向外的壓力來對抗外壓
所以現在看到的小氣泡,是達到內外壓力平衡的狀態
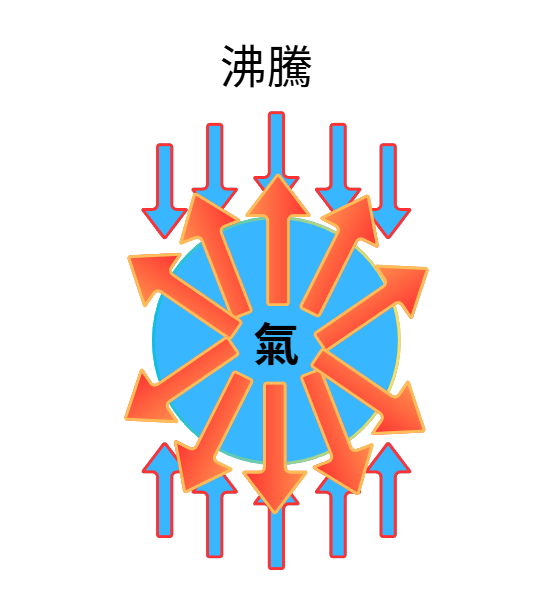
一旦加熱到100℃、達沸騰狀態時
氣泡內部的水蒸氣變得非常躁動,體積膨脹,內部壓力急遽上升
整顆氣泡非常難受,想要趕快逃離開這裡
於是氣泡就突破外壓、從水中迅速膨脹、上升,將水蒸氣釋放到大氣中
所以我們就會觀察到水沸騰、冒泡
所以「達到沸點時,液體蒸氣壓剛好等於外界壓力」一開始要理解這句話不容易
其實就是溫度高到「平常蒸發狀態就能沸騰」的程度,以達到內外壓力平衡
所以為什麼「水100°C時蒸氣壓是760 mmHg」
是因為到達沸點的時候,水的蒸氣壓(蒸發所產生的壓力)就是一大氣壓
| 外界壓力 | 單位 (mmHg) | 沸點 (°C) |
|---|---|---|
| 0.05 atm | 38 mmHg | 33°C |
| 0.1 atm | 76 mmHg | 46°C |
| 0.2 atm | 152 mmHg | 60°C |
| 0.3 atm | 228 mmHg | 70°C |
| 0.5 atm | 380 mmHg | 81°C |
| 1.0 atm | 760 mmHg | 100°C |
| 2.0 atm | 1520 mmHg | 120°C |
| 3.0 atm | 2280 mmHg | 133°C |
| 4.0 atm | 3040 mmHg | 143°C |
當外界壓力越高,達到沸點所需的溫度就越大,因為有更多的力量壓在外面
當外界沒什麼壓力時,外面壓制不住,分子就容易躁動,一點點溫度就能使水沸騰
熔點的定義
那同樣地,熔點的定義(從最Low到高階精準的說法):
1 (國中程度)0℃2 (高中程度)發生融化時的溫度3 (大學程度)先Pass,因為這裡不一樣了,液體與固體自由能相等的時候(熱力學的東西,沒辦法單純用壓力解釋)
所有東西都會自然蒸發
老實講這顛覆我原本想像:
在常溫常壓下,幾乎所有東西都有極微小的蒸氣壓,會緩慢升華或蒸發,但黃金與鑽石幾乎不會
人會蒸發、書本會蒸發、自動鉛筆會蒸發、電腦和CPU也都慢慢蒸發
理論上所有東西都會極微小蒸發,只是速率慢到不可觀測,時間是天文級別
表面接觸到外界,分子就會緩緩地私自出走
雖然內部分子被包得緊緊的、被各種束縛,但表面分子感受到的束縛只有一小部分,所以能逃逸、離家出走
(從微觀來看,分子能量隨機分布、有高有低,當 ![]() 分子就可以逸出),這就是蒸發的核心本質
分子就可以逸出),這就是蒸發的核心本質
這也是空氣中灰塵的來源之一
所以塑膠微粒的問題沒辦法完全避免
只要有塑膠製品就會慢慢蒸發、產生塑膠微粒,對人體造成微量影響
從熱力學角度來看
事物傾向往「無序(熵增)」的方向演化,並且蒸發速率隨溫度呈指數增長
以CPU為例,一公克的CPU蒸發所需時間估計為:
25°C → 超過宇宙年齡
1000°C → 幾億年
2000°C → 幾十分鐘
3000°C → 幾秒鐘
溫度越高蒸發速度越快(加熱到視同拿去燒了)
最終達到矽的沸點(3000多度)



發佈留言